Ny biologisk medisin for de med psoriasisartritt
En ny behandling for de med psoriasisartritt er godkjent av Beslutningsforum for nye metoder. Den biologiske medisinen vil ikke være tilgjengelig via sykehusenes anbudslister før februar neste år.
Avgjørelsen ble tatt på møtet de hadde 29. april. Den nye medisinen heter Taltz (iksekizumab), og er godkjent for bruk i behandling av psoriasisartritt hos voksne pasienter som ikke har hatt adekvat respons på, eller er intolerante mot, en eller flere DMARD-behandlinger. Det er en såkalt interleukin 17A- hemmer (IL-17A og IL-A/F).
Prisen må ikke endres
Legemiddelet skal inngå i framtidige LIS-anbud.
– Det kan først tas i bruk på denne indikasjonen fra neste anbud, som trer i kraft fra 1. februar 2020. Det er da en forutsetning at prisen er lik, eller lavere, enn den prisen som er grunnlaget for denne beslutningen, skriver de.
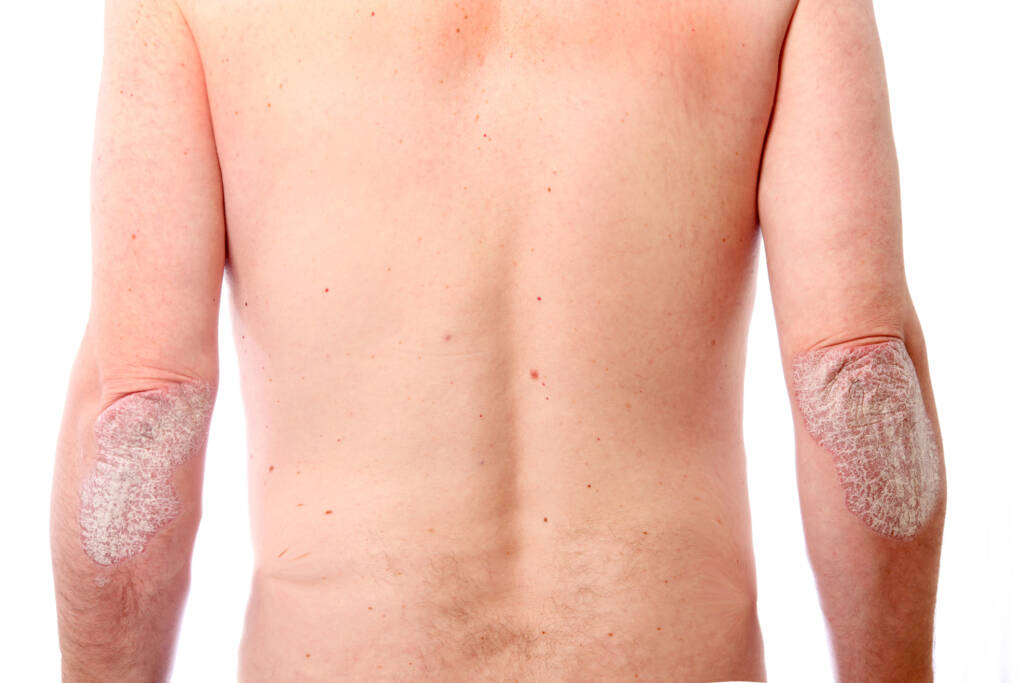
Taltz har vært godkjent av beslutningsforumet for behandling av moderat til alvorlig plakkpsoriasis hos voksne som er aktuelle for systemisk behandling siden september 2018. Den kan gis alene eller i kombinasjon med metotreksat.
LES MER OM PSORIASISARTRITT HER
Dosering
Medisinen kommer som ferdig fylt sprøyte eller penn på 80 mg, som man setter selv i underhudsfettet (subkutant). Hudområder med psoriasis bør unngås ved valg av injeksjonssted, og injeksjonssted bør varieres.
Anbefalt dose er 160 mg (to injeksjoner à 80 mg) ved uke 0, deretter 80 mg (en injeksjon) hver 4. uke. Dersom man har både psoriasisartritt og moderat til alvorlig plakkpsoriasis anbefales medisinen å doseres som for de med plakkpsoriasis. Da starter man med 160 mg (to injeksjoner à 80 mg) som subkutan injeksjon ved uke 0, deretter 80 mg ved uke 2, 4, 6, 8, 10 og 12. Etter dette er det en vedlikeholdsdose på 80 mg hver 4. uke.
Bivirkningene som er beskrevet er på lik linje med de fleste andre biologiske produktene. Det gjelder ting som hyppigere øvre luftveisinfeksjoner, munnsopp, øyekatarr og kvalme.
Kan vurderes på nytt
Dette er Beslutningsforums nye vurdering av Taltz.
– Beslutningen som er fattet er resultat av en lang prosess og en grundig vurdering av de menneskelige konsekvenser som følger både av beslutning om innføring, så vel som beslutning om ikke å innføre en behandlingsmetode. Dersom det tilkommer nye opplysninger (herunder pasientsikkerhet, kostnadseffektivitet, pris, biotilsvarende/generika, overlevelsestall m. m.) som endrer resultatet vesentlig, vil beslutningen kunne vurderes på nytt, skriver forumet i sitt vedtak.
LES OGSÅ: Disse biologiske medisinene er godkjent for de ulike spondyloartrittdiagnosene
Ikke godkjent
Medisinen Ilumetri (tildrakizumab), til behandling av moderat til alvorlig plakkpsoriasis, ble ikke godkjent i denne omgangen.
– Prisen for legemidlet er for høy. Det er ikke dokumentert eventuelle fordeler ved den, som kan tilsi at dette preparatet kan ha en høyere pris enn andre godkjente biologiske behandlingsalternativer til bruk ved moderat til alvorlig plakkpsoriasis, står det i protokollen.
Et nytt legemiddel for de med moderat til alvorlig revmatoid artritt (leddgikt) skulle også ligge på bordet til møtet, men saken ble trukket som følge av mangler i saksgrunnlaget. Det gjelder medisinen Kevzara (sarilumab).